Repetición de motivos en un
mosaico
Repetición de motivos en un
mosaico

Repetición de motivos en una
formación militar
Si nos fijamos con detenimiento, en estos
dibujos de arriba hay siempre
una fracción de los mismos que se repite. Pues bien, en los
cristales, los átomos, los iones o las moléculas
se
empaquetan dando lugar a motivos que se repiten desde cada 5 Angstrom
hasta las centenas de Angstrom (1 Angstrom = 10-8
cm), y a esa repetitividad, en tres dimensiones, la denominamos red cristalina. El conjunto que se repite, por
traslación ordenada, genera toda la red (todo el cristal) y
lo denominamos celdilla
elemental
ó celdilla
unidad.
Para generalizar, su contenido (átomos,
moléculas,
iones), o sea el motivo que se repite, puede describirse por un punto
(el
punto reticular) que representa a todos y cada uno de los
constituyentes del motivo. Por ejemplo, cada soldado sería
un
punto reticular. En la materia condensada, un monocristal es un
dominio, generalmente poliédrico, de un medio cristalino.
Estructura
cristalina de un material inorgánico, el α-cuarzo
Donde
sí se
distinguen claramente unidades aisladas, es en los llamados materiales
orgánicos,
en donde aparece el
concepto de entidad molecular (molécula),
formada por átomos enlazados entre sí, pero en
donde la
unión entre las moléculas, dentro del cristal, es
mucho
más débil (cristales
moleculares).
Son generalmente materiales más blandos e inestables que los
inorgánicos...


Izquierda: Diamante
(carbono puro)
Derecha:
Grafito (carbono puro)
El
grafito es negro,
blando y un lubricante excelente, lo que sugiere que sus
átomos deben estar distribuidos (empaquetados) de un modo
que puedan
entenderse sus propiedades. Sin embargo, el diamante es transparente y
muy duro, por lo que debe esperarse que sus átomos
estén muy fijamente unidos. En efecto, sus
estructuras sub-microscópicas (a nivel atómico)
dan cuenta de sus diferencias...
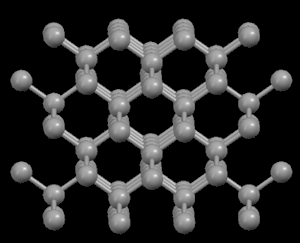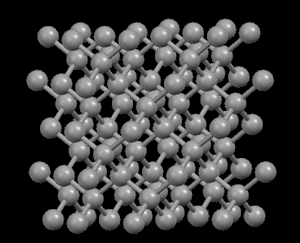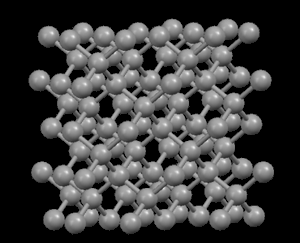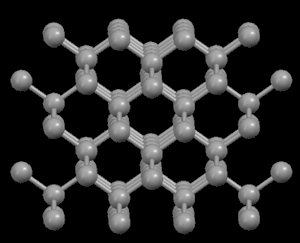
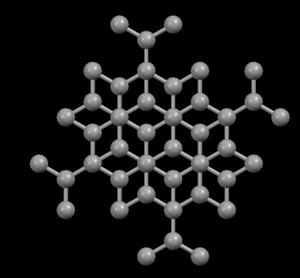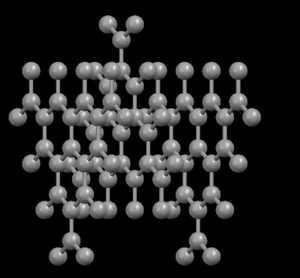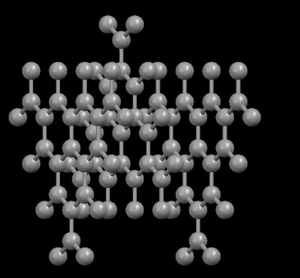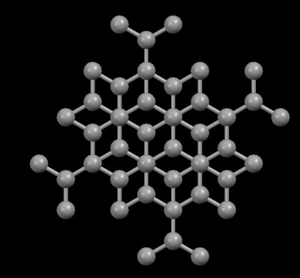
Izquierda: Diamante,
con estructura muy compacta
Derecha: Grafito,
con
estructura atómica en láminas
En
el diamante, cada
átomo de carbono está unido a otros cuatro en
forma de
una red tridimensional muy compacta (cristales
covalentes),
de ahí su extrema dureza y su caracter aislante. Sin
embargo, en
el
grafito los átomos de carbono están distribuidos
en forma
de
capas paralelas separadas entre sí mucho más de
lo que se
separan entre sí los átomos de una misma capa.
Debido a
esta unión tan debil entre las capas atómicas del
grafito, los deslizamientos de unas frente a otras ocurre sin gran
esfuerzo, y de ahí su capacidad lubricante, su uso en
lapiceros
y su utilidad como conductor.