Estructura de los
cristales. El
estado cristalino

Es
conocido que la materia está formada por átomos
(y/o
iones) que en ocasiones se agrupan para formar lo que conocemos con el
nombre de moléculas. Históricamente, estos
agregados
(atómicos, iónicos o moleculares) se han venido
clasificando en los tres estados fundamentales de la materia: gas,
líquido y sólido. Pues bien, el denominado estado
cristalino corresponde fundamentalmente al estado sólido,
pero
con unas características muy especiales.
La materia se considera
estrictamente cristalina si los
átomos,
iones o moléculas que la componen se distribuyen, en las
tres
direcciones independientes del espacio, de un modo regular y
repetitivo,
y a esta forma de materia la denominamos cristal,
una palabra
(κρύσταλλος,
crustallos,
o fonéticamente kroos'-tal-los
= frío + gota) que los antiguos griegos identificaron con el
mineral cuarzo,
definiéndolo como carámbanos de
extraordinaria dureza y muy fríos. Los cristales suelen
evidenciar su orden interno por la aparición de
morfologías externas regulares, es decir, caras y aristas
reconocibles. Este es el caso de los dos ejemplares de cristales
minerales que se muestran a continuación...

 Cristales de cuarzo (izquierda) y boleita
(un mineral
complejo del grupo de los haluros)
Cristales de cuarzo (izquierda) y boleita
(un mineral
complejo del grupo de los haluros)
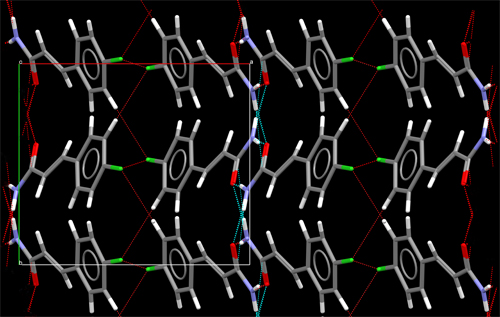 Empaquetamiento
cristalino de moléculas mostrando su distribución
ordenada, que se extiende en todas las direcciones del espacio
Empaquetamiento
cristalino de moléculas mostrando su distribución
ordenada, que se extiende en todas las direcciones del espacio
Aunque
generalmente el concepto de cristal se asocia con el estado
sólido que muestran los minerales, las moléculas
biológicas como las proteínas dan lugar a
cristales
extremadamente frágiles, con contenidos de agua que llegan
hasta
el 80% del volumen del cristal, representando un ambiente
más
próximo al estado líquido que al
sólido, pero que
en general mantienen una morfología que delata su orden
interno.
 Cristales
de proteína, que contienen agua en su interior,
¡hasta un 80% de su volumen!
Cristales
de proteína, que contienen agua en su interior,
¡hasta un 80% de su volumen!
En otro sentido el
estado cristalino puede considerarse
también
como un límite de la evolución del estado
líquido
hacia el sólido. En el estado líquido las
moléculas, muy próximas entre sí,
entran en
contacto y conservan una cierta atracción con sus
vecinas,
y de ahí que cuando trasvasamos un líquido de un
recipiente a otro, éste mantiene su volumen. Sin embargo, en
parte debido a la agitación térmica, dicha
unión
no es lo suficientemente estable como para mantener rígido
el
volumen del líquido. Si reducimos la agitación
térmica la frágil unión entre las
moléculas
se hace cada vez más estable, llegando a un estado
relativamente
rígido. Si la disminución térmica ha
sido lo
suficientemente lenta, las moléculas generalmente
acaban
en un estado ordenado que corresponde a la situación
más
estable posible, la de menor energía. Ese es el estado
cristalino.

Moléculas
de agua en estado líquido. Se atraen mediante interacciones
de
tipo dipolo-dipolo, denominadas enlaces de hidrógeno. Debido
a
la agitación térmica, estas interacciones son
poco
estables
 La
estructura ordenada de un cristal de nieve se mantiene estable mediante
enlaces de hidrógeno que interconectan las
moléculas en
todas las direcciones del espacio
La
estructura ordenada de un cristal de nieve se mantiene estable mediante
enlaces de hidrógeno que interconectan las
moléculas en
todas las direcciones del espacio
Pero, volvamos
al punto de partida...
Tabla de
contenido









