Estructura de los
cristales. Fuerzas
interatómicas en los cristales

Los
cristales están formados por átomos, iones y/o
moléculas que se empaquetan conjuntamente de un modo
ordenado y
periódico. Este hecho es la evidencia de la presencia de
determinadas fuerzas
que mantienen los átomos unidos y que se clasifican en dos
grandes grupos, el enlace
covalente, que fundamentalmente mantiene átomos
unidos en forma de moléculas, y el no-covalente, quien
a su vez se clasifica en otros muchas tipologías.
Enlace
covalente
Entre todas las
fuerzas que mantienen los átomos unidos, las
de mayor fortaleza están representadas por el enlace
covalente,
en donde los átomos implicados comparten sus electrones
más externos para formar el enlace, siendo muy dificil
separar los átomos unidos por
un enlace de este tipo. Uno de los mejores ejemplos de fortaleza de
dicho
enlace es la estructura del diamante, en la cual, cada átomo
de
carbono está unido a otros cuatro vecinos (ver figuras de
abajo).
El enlace
covalente simple entre dos átomos de carbono en la
estructura
del diamante, formado por la compartición de 2 electrones de
sus
capas más externas. En
la estructura del diamante cada átomo de carbono comparte
electrones con cuatro de sus átomos vecinos, formando cuatro
enlaces covalentes simples. Esta estructura es como un
armazón
gigante de enlaces covalentes que se propagan en las tres dimensiones
del espacio.


En
los compuestos moleculares, orgánicos y
biológicos, los
átomos están unidos fuertemente a
través de
enlcaes covalentes
Enlace
no-covalente
El enlace
no-covalente
no es tan fuerte como el covalente, pero el efecto aditivo de varios
enlaces no-covalentes puede llegar a estabilizar una
molécula o
un conjunto de átomos. En contraste con los enlaces
covalentes,
los no-covalentes no comparten electrones.
Este tipo de interacción incluye:
Excluyendo el enlace
metálico, las interacciones no-covalentes son el tipo de
interacciones dominantes entre los átomos y
moléculas, y
son determinantes para mantener no sólo la forma de las
moléculas orgánicas y de las
macromoléculas
(proteínas y ácidos nucleicos), sino sus
correspondientes estructuras cristalinas.
Enlace metálico
El enlace
metálico
puede describirse como una interacción colectiva de un
fluido de
electrones móviles con iones metálicos (ver
figura de la
derecha). Este tipo de enlace ocurre en la estructura de los metales,
es decir, allí donde los electrones de valencia
sólo
representan una fracción muy pequeña del
número
de coordinación del átomo
metálico, y por lo
tanto no se pueden establecer enlaces covalentes o iónicos.
El enlace metálico es algo más débil
que el iónico o el covalente.
Enlaces metálicos en la plata
Enlace iónico
El denominado enlace
iónico
está constituido por fuerzas de atracción, de
carácter electrostático y muy potentes, entre
iones
positivos y negativos. El vínculo que genera este tipo de
enlace no es direccional, lo que significa que la atracción
electrónica no favorece a un átomo más
que a otro.
Los sólidos iónicos pueden estar compuestos por
iones
simples, tal como se observa en el NaF (fluoruro sódico,
figura
de la derecha), o por iones poliatómicos, tal como se
observa en
el nitrato amónico, NH4NO3,
con iones
NH4+ y NO3- (ver
figura de abajo).
Estructura iónica del nitrato
amónico
Formación de un enlace
iónico en el fluoruro sódico
Estructura atómica del
fluoruro sódico
Fuerzas de van der Waals
Las fuerzas
de van der Waals
(en parte conocidas como fuerzas
London) son fuerzas residuales, de
atracción o repulsión
entre moléculas o
grupos atómicos, que no se derivan de las de un enlace
covalente, o de la interacción electrostática
entre
iones, o de grupos iónicos entre sí o con
moléculas neutras. Al igual que los enlaces de
hidrógeno,
las fuerzas de van der Waals se basan en dipolos, es decir, en una
diferencia de carga entre dos átomos o moléculas.
Pero a
diferencia de los enlaces de hidrógeno, las fuerzas de van
der
Waals suelen ser dipolos no permanentes, es decir, transitorios.
Las fuerzas de van der Waals son
relativamente muy débiles
en
comparación con los enlaces covalentes, pero
desempeñan
un papel fundamental en campos tan diversos como la química
supramolecular, biología estructural, ciencia de
polímeros, nanotecnología, ciencia de superficies
y
física de la materia condensada. Las fuerzas de van
der
Waals determinan muchas de las propiedades de los compuestos
orgánicos, incluyendo su solubilidad en medios polares y no
polares.
Fuerzas atractivas resultantes de la
interacción entre
dipolos
Interacciones
hidrofóbicas
La interacción
hidrofóbica
describe las fuerzas existentes entre el agua y los compuestos llamados
hidrófobos (moléculas con muy baja solubilidad en
agua).
Los compuestos hidrófobos son moléculas no
polares que
usualmente contienen largas cadenas carbonadas que no interaccionan con
las moléculas de agua. La mezcla entre grasas
y agua es un
buen ejemplo de esta interacción particular (el agua y las
grasas no se mezclan) . Un grupo de moléculas no polares se
aglutinan entre sí para excluir el agua.
Al hacerlo
así, minimizan la superficie que exponen frente al
disolvente
polar.
Este tipo de interacciones son factores importantes que impulsan el
plegamiento de las proteínas, o la inserción de
las
proteínas de membrana en el entorno no polar de los
lípidos. Igualmente contribuyen a la estabilidad de las
asociaciones entre proteínas y pequeñas
moléculas.
Esquema que, como ejemplo,
muestra átomos
y aminoácidos implicados en interacciones
hidrófobicas (arcos con pestañas)
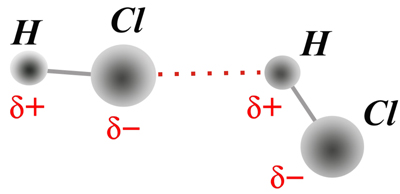
Enlace de
hidrógeno
El enlace
de hidrógeno aparece cuando un átomo de
hidrógeno, unido covalentemente a un átomo
electronegativo (p. ej. O, N, S), es compartido con otro
átomo, también de carácter
electronegativo.
El enlace de
hidrógeno
(también conocido como puente de hidrógeno) se
describe
frecuentemente como una interacción
electrostática de
tipo dipolo-dipolo. Sin embargo, también tiene algunas
características de unión covalente: es
direccional y
fuerte, produce distancias interatómicas más
cortas que
la suma de los radios de van der Waals de los átomos
implicados,
y por lo general implica un número limitado de
átomos
implicados en la interacción.
Los enlaces de hidrógeno pueden ocurrir entre
moléculas
(intermoleculares) o entre diferentes partes de una misma
molécula (intramoleculares). Son más fuertes que
las
interacciones de van der Waals, pero más débiles
que los
enlaces covalentes o iónicos. Este tipo de enlaces puede
ocurrir
entre moléculas inorgánicas, tales como agua
líquida o sólida, y en moléculas
orgánicas.
Es muy frecuente en macromoléculas como el ADN y las
proteínas.
Ejemplo de moléculas
orgánicas unidas por enlaces de hidrógeno
Los enlaces de hidrógeno que se forman en el agua
líquida se forman y deshacen constantemente...
En el agua líquida los enlaces de hidrógeno se
están formando y deshaciendo contínuamente
En
el agua sólida y cristalina, es decir, en la nieve, los
enlaces
de hidrógeno son permanentes y son los mayores responsables
de
la estructura de estos cristales...
Las
moléculas de agua, unidas por enlaces de
hidrógeno,
mantienen la estructura tridimensional de los copos de nieve
Pero, volvamos
al punto de partida...
Tabla de
contenido